Фотозвіти прислати на вайбер +380969968375
З початком нового навчального року!
Бажаю успіхів у навчанні!
02.09.2022
Прошу приєднатись за посиланням
03.06.2022-08.06.2022-10.06.2022
Тема. Хімія і прогрес людства. Узагальнення та систематизація знань
Навести приклади впливу хімії на розвиток людства
27.05.2022-01.06.2022
Тема. "Зелена" хімія: Сучасні завдання перед хімічною наукою та хімічною технологією
Підготувати приклади застосування знань з хімії у сучасному житті.
20.05.2022- 25.05. 2022
Тема. Роль хімії у розв'язанні енергетичної та екологічної проблем.
Навчальний проєкт :"Вирішення проблеми утилізації різних видів електричних ламп "
Підготувати матеріали до проєкту.
18.05.2022
Тема: Роль хімії у розв'язанні енергетичної та екологічної проблеми. Навчальний проект: Вирішення проблеми утилізації різних видів електричних ламп.
Хімія та екологія
Опрацювати параграф 39, скласти конспект, Виконати проект на завдану тему "Вирішення проблеми утилізації різних видів електричних ламп." або запропонуйте власний план заощадження енергетичних ресурсів, які використовує ваша родина.
Значення хімії у розв’язанні енергетичної проблеми
Забезпеченість енергією є найважливішою умовою соціально-економічного розвитку країни, її промисловості, транспорту, сільського господарства, сфер культури і побуту.
Традиційними джерелами енергії є найчастіше невідновні природні ресурси – вугілля, нафта, природний газ, торф, сланці. Останнім часом вони дуже швидко виснажуються. Не дивно, що це породжує енергетичну проблему.
Хіміки вважають, що в майбутньому (приблизно ще років 25–30) нафта збереже свою позицію лідера. Але її внесок в енергоресурси помітно скоротиться і буде компенсуватися зрослим внеском вугілля, газу, водневої енергетики, ядерного пального, енергії Сонця, енергії земних глибин та інших видів відновної енергії, включаючи біоенергетику.
Поповнення паливних ресурсів у майбутньому пов’язують із раціональною переробкою вугілля. Наприклад, подрібнене вугілля змішується з нафтою, на добуту пасту діють воднем під тиском. При цьому утворюється суміш вуглеводнів – штучний бензин.
Дуже перспективною видається воднева енергетика. Вона ґрунтується на спалюванні водню, під час якого не виникають шкідливі викиди.
Невичерпні можливості містить ядерна енергетика. Її розвиток для виробництва електроенергії та теплоти дає змогу вивільнити значну кількість органічного палива.
Великі надії покладаються й на використання сонячної радіації (геліоенергетика). У Криму вже діють сонячні батареї, фотогальванічні елементи, які перетворюють сонячне світло в електрику. Сонячні батареї вже давно застосовують у навігаційних спорудах і на космічних кораблях. На відміну від ядерної, вартість енергії, яку добувають за допомогою сонячних батарей, постійно знижується.
Для виготовлення сонячних батарей головним напівпровідниковим матеріалом є силіцій та його сполуки. Нині хіміки працюють над розробкою нових матеріалів – перетворювачів енергії. Це можуть бути різні системи солей як накопичувачі енергії.
Екологія – це наука про відносини організмів між собою та з довкіллям.
Головними забрудниками довкілля є теплоелектростанції, кольорова металургія, транспорт. Наприклад, щороку в атмосферу викидається 100 млн. тон сульфур(IV) оксиду SO2. Більше половини цієї кількості припадає на частку теплоелектростанцій, чверть – на частку кольорової металургії і лише кілька відсотків – на частку чорної металургії та основної хімічної промисловості. Те саме можна сказати про викиди оксидів нітрогену та вуглекислого газу, про тверді пилові викиди і канцерогенні мікроелементи.
З метою захисту довкілля в хімічній промисловості використовують різні фільтри, пилогазовловлювачі, які значно зменшують викидання шкідливих речовин в атмосферу.
Синтетичні полімери на відміну від природних не розкладаються ферментами і залишаються в природі. Коли ж їх після використання спалюють, то тим самим лише збільшують забруднення повітря. Перед хіміками стоїть завдання розробки способів утилізації синтетичних матеріалів і створення нових полімерів, які б розкладалися в природі.
Дуже гостро постала проблема раціонального використання води і неприпустимості забруднення водойм. При цьому враховують, що прісна вода становить тільки близько 2,5 % від загальної кількості води на Землі. Кардинальне розв’язання проблеми полягає у створенні замкнених (безстічних) технологічних систем, коли використана вода очищується і знову повертається у виробництво.
20.05.2022
Тема: Роль хімії у розв'язанні сировинної та продовольчої проблеми
Опрацювати параграф 38, дати письмові відповіді на запитання 1-2 на с. 200
Значення хімії у розв’язанні сировинної проблеми
Сировиною називають природні матеріали, що використовуються у виробництві промислових продуктів.
Природа, що нас оточує, здається, є невичерпною скарбницею, з якої промисловість бере сировину. Але невідповідність між запасами і споживанням деяких видів сировини висуває проблему її бережливого й раціонального використання. У зв’язку з цим хіміки ставлять перед собою такі найголовніші завдання:
1) розвідування й застосування дешевої сировини, нових видів альтернативних сировинних матеріалів;
2) комплексне використання сировини;
3) розробка нових ефективних методів рециркуляції сировини;
4) використання відходів як сировини.
Комплексне використання сировини спрямоване на застосування всіх її головних частин для добування корисних продуктів або матеріалів.
Рециркуляція, регенерація сировини – це переведення речовин, що прореагували, у початковий стан для їх повторного використання. Наприклад, уже зараз досить широко використовуються метали у вигляді вторинної сировини, так званого скрапу. Майже половина світового виробництва сталі базується на скрапі.
Невичерпним джерелом сировини є промислові й побутові відходи. Завдання хіміків полягає у знешкодженні відходів. Для цього будують спеціальні очисні споруди. Але головне завдання хіміків полягає у створенні безвідходних виробництв, де відходи використовуються для виготовлення необхідних продуктів.
Опрацювати параграф 38, дати письмові відповіді на запитання 1-2 на с. 200
13.05.2022
Тема: Роль хімії у створенні нових матеріалів, розвитку нових напрямів технологій
Опрацювати параграф 37. Виписати та вивчити визначення, дати письмову відповідь на запитання 3 на с. 196 ( на прикладі двох вчених)
Значення хімії у створенні нових матеріалів
Речовини, що використовуються для виготовлення будь-якого фізичного тіла, називаються матеріалами.
Розрізняють матеріали металічні та неметалічні. До металічних матеріалів належать сплави на основі заліза – чавун і сталь, на основі міді – бронза і латунь, на основі алюмінію, магнію, ніобію, танталу, цирконію тощо. З металічних сплавів виготовляють теплообмінники, ємкості, мішалки, трубопроводи, контактні апарати та інше.
Для поліпшення якості металічних матеріалів використовують порошкову металургію. Вона включає процеси виробництва неметалічних порошків і спікання з них виробів. Сучасна порошкова металургія займається створенням матеріалів і виробів з таким складом, структурою, властивостями, яких неможливо досягти відомими методами плавлення. Поряд із цим, порошкова металургія вирішує проблему виготовлення й традиційних матеріалів і виробів, але за вигідніших техніко-економічних показників виробництва.
Серед неметалічних матеріалів важливого значення набули полімери на основі фенолоформальдегідних смол, полівінілхлориду, поліетилену, фторопластів. На відміну від металічних, ці матеріали виявляють високу стійкість до агресивних середовищ, мають низьку густину, високу тривкість до стирання, добрі діелектричні та теплоізоляційні властивості.
Останнім часом вимоги до матеріалів неухильно зростають. З огляду на це зростає також роль хімії у створенні нових матеріалів. Особливе місце серед нових матеріалів посідають композити.
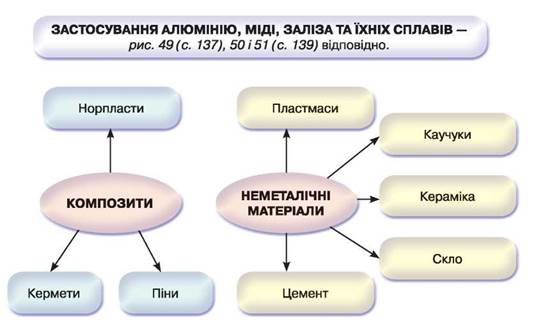
Композити – це композиційні матеріали, що складаються з пластичної основи (матриці) та наповнювача.
Серед композитів виділяють кермети (кераміко-металічні матеріали), норпласти (наповнені органічні полімери) і піни (газонаповнені матеріали).
Опрацювати параграф 37. Виписати та вивчити визначення, дати письмову відповідь на запитання 3 на с. 196 ( на прикладі двох вчених)
11.05.2022
Контрольна робота
Письмово виконати завдання
20,
21,
22,
24,
25,
26,
27,
28,
34,
35,
36 а,
38
На с. 187-189.
04.05.2022-06.05.2022
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ МАСОВОЇ ЧАСТКИ ЕЛЕМЕНТА У ФОРМУЛІ
Обчислити масову частку елемента в складі речовини за її формулою означає встановити, яка частина складної речовини припадає на частку кожного елемента.
ω (Е) =
де n – число атомів елемента у формулі речовини;
Е – елемент; ω – масова частка елемента;
Масову частку виражають у відсотках, або частках від одиниці.
Алгоритм розв’язку задач:
Запис скороченої умови задачі;
Обчислюємо відносну молекулярну масу сполуки;
Обчислюємо масову частку елемента за формулою.
Якщо сполука складається з двох елементів, то масову частку другого елемента можна визначити різницею цілого і відомою масовою часткою.
Задачі для розв’язку:
1. Обчисліть масову частку Оксигену у воді.
2. Обчисліть масову частку Карбону в диоксиді Карбону СО2;
3. Обчисліть масові частки елементів у нітратній кислотіHNO3
4. Обчисліть масові частки елементів у кальцій оксидіCaO
5. Обчисліть масові частки елементів у метані СН4;
6. У якій речовині масова частка Карбону більша - у вуглекислому газі СО2 чи чадному газі СО.
7. Масова частка якого елемента у сполуці AgNO3 найменша
8. Масова частка якого елемента у сполуціFeSO4 найбільша.
9.Якого елемента –Феруму чи Купруму – більше в мідному колчедані CuFeS2;
10.Розрахувати масову частку кристалізаційної води в пентагідратікупрум (ІІ) сульфату CuSO4 * 5H2O
Повторити параграф 20-23
ОБЧИСЛЕННЯ МАСОВОЇ ЧАСТКИ ЕЛЕМЕНТА У ФОРМУЛІ
Обчислити масову частку елемента в складі речовини за її формулою означає встановити, яка частина складної речовини припадає на частку кожного елемента.
ω (Е) =
де n – число атомів елемента у формулі речовини;
Е – елемент; ω – масова частка елемента;
Масову частку виражають у відсотках, або частках від одиниці.
Алгоритм розв’язку задач:
Запис скороченої умови задачі;
Обчислюємо відносну молекулярну масу сполуки;
Обчислюємо масову частку елемента за формулою.
Якщо сполука складається з двох елементів, то масову частку другого елемента можна визначити різницею цілого і відомою масовою часткою.
Задачі для розв’язку:
1. Обчисліть масову частку Оксигену у воді.
2. Обчисліть масову частку Карбону в диоксиді Карбону СО2;
3. Обчисліть масові частки елементів у нітратній кислотіHNO3
4. Обчисліть масові частки елементів у кальцій оксидіCaO
5. Обчисліть масові частки елементів у метані СН4;
6. У якій речовині масова частка Карбону більша - у вуглекислому газі СО2 чи чадному газі СО.
7. Масова частка якого елемента у сполуці AgNO3 найменша
8. Масова частка якого елемента у сполуціFeSO4 найбільша.
9.Якого елемента –Феруму чи Купруму – більше в мідному колчедані CuFeS2;
10.Розрахувати масову частку кристалізаційної води в пентагідратікупрум (ІІ) сульфату CuSO4 * 5H2O
Повторити параграф 20-23
27.04.2022-29.04.2022
Тема. Виконання тренувальних вправ на розв’язок розрахункових задач
ОБЧИСЛЕННЯ ЧИСЛА АТОМІВ У ПЕВНІЙ КІЛЬКОСТІ РЕЧОВИНИ
Обчислення здійснюється за формулою: υ =
де NA– число Авогадро - 6,02 *1023; N – число атомів чи молекул; υ – кількість речовини (моль). Пам’ятайте, 1 моль містить NA частинок.
Задачі для розв’язку:
1. Обчисліть скільки молекул води міститься в 5 моль цієї речовини.
2. Скільки молекул аміаку NH3 міститься в 10 моль цієї речовини.
3. Скільки молекул метану СН4 міститься в 3,3 моль цієї речовини.
4. Яку кількість речовини становить 1,8 *1023 молекул сірководню Н2S.
5. Яку кількість речовини становить 4,8 * 1023 молекул нітратної кислоти HNO3.
6. Яку кількість речовини становить 12,04 *1023 молекул азоту.
Повторити параграф 24-27
Обчислення здійснюється за формулою: υ =
де NA– число Авогадро - 6,02 *1023; N – число атомів чи молекул; υ – кількість речовини (моль). Пам’ятайте, 1 моль містить NA частинок.
Задачі для розв’язку:
1. Обчисліть скільки молекул води міститься в 5 моль цієї речовини.
2. Скільки молекул аміаку NH3 міститься в 10 моль цієї речовини.
3. Скільки молекул метану СН4 міститься в 3,3 моль цієї речовини.
4. Яку кількість речовини становить 1,8 *1023 молекул сірководню Н2S.
5. Яку кількість речовини становить 4,8 * 1023 молекул нітратної кислоти HNO3.
6. Яку кількість речовини становить 12,04 *1023 молекул азоту.
Повторити параграф 24-27
20.04.2022- 22.04 2022
Тема. Генетичні зв'язки між неорганічними речовинами.
Виконати завдання 4 на с. 180.
13.04.2022-15.04.2022
Тема. Генетичні зв'язки між основними класами неорганічних сполук. Практична робота 2.
Опрацювати параграф 34, писмово дати відпові на завдання 1 на с. 180
06.04.2033-08.04.2022
Тема. Біологічне значення металічних та неметалічних елементів.
Опрацювати параграф 32, прочитати, запам’ятати та стисло описати значення елементів.
01.04.2022
Тема. Мінеральні добрива. Поняття про кислотні та лужні ґрунти.
Опрацювати параграф 30, прочитати вивчити визначення, письмово дати відповіді на запитання 1-6 на с. 163
30.03.2022
Тема. Сучасні силікатні матеріали
Опрацювати параграф 31, прочитати, вивчити визначення, письмово дати відповіді на запитання 1-3, або 1-4 на с. 170
25.03.2022
Тема. Поняття про жорсткість води та способи її усунення.
Навчальний проєкт "Усунення тимчасової і постійної жорсткості води"
Опрацювати параграф 28. Прочитати та вивчити визначення, дати письмові відповіді на запитання 1-5 на с. 153.
23.03.2022
Тема. Узагальнення знань з теми " Неорганічні речовини та їх властивості"
Повторити параграфи 15-27, письмово завдання 36, 37 на с. 189
25.02.2022
Тема. Розрахункові задачі
Опрацювати параграф 29. Прочитати та вивчити визначення, дати письмові відповіді на запитання 1-3 на с. 15
04.02.2022
Тема. Солі, їх поширення в природі. Середні та кислі солі
Опрацювати параграф 27, дати письмові відповіді на запитання після параграфу.
20.20.2022
Тема. Основи. Властивості гідроксидів Натрію та Кальцію, їх застосування
Опрацювати параграф 26, дати письмові відповіді на запитання після параграфу.
19.11.2021
Тема: Окисні властивості неметалів, застосування.
Опрацювати параграф 17, письмово завдання 1 червоне на с. 92
17.11.2021
Тема: Явище адсорбції.
Повторити с. 79, опрацювати параграф 17, письмово завдання 1 сине на с. 92
12.11.2021
Тема: Алотропні модифікації Сульфуру, Фосфору
Опрацювати параграф 16, с. 86-87, класти 4 тестових запитання до параграфу з відповідями.
10.11.2021
Тема: Алоторпія. Алотропні модифікації Оксигену, Карбону. Навчальний проєкт: "Штучні алмази у техніці"
Опрацювати параграф 16, с. 82-86, склати конпект, письмово завдання застосовуємо 2-3 на с. 88
05.11.2021
Тема: Неметали: загальна характеристика, фізичні властивості
Опрацювати парграф 15, виписати та вивчити визначення, завдання 1-5 на с. 81-82 письмово в зошит
03.11.2021
Тема: Хімічні реакції
Повторити параграфи 9-13, завдання 1-9, 11-14, письмово в зошит
29.10.2021
Тема: Виконання тренувальних вправ та розвязок розрахункових задач
Повторити параграфи 9-13, завдання 10-15 на с. 74 письмово в зошит
Підготовка до ЗНО: повторити типи реакцій
27.10.2021
Тема: Поняття про гальванічний елемент як хімічне джерело електричного струму.
Навчальні проєкти:
7. Гальванічний елемент з картоплі, лимону.
8. Види і принципи роботи малих джерел електричного струму, утилізація їх.
Опрацювати параграф 13, вивчити визначення, завдання 3 (знаємо, розуміємо) та 1(застосовуємо письмово) на с.71
15.10.2021
Тема: Гідроліз солей
Опрацювати параграф 12, знати відповіді на запитання 1-5 сині, письмово відповісти на запитання 1-3 на с. 68 червоні
Підготовка до ЗНО: повторити кристалогідрати.
06.05.2021
Тема: Роль хімії у розвязанні сировинної та продовольчої проблеми
Опрацювати параграф 38 на с. 197, письмово запитання 1-3 на с. 200
05.05.2021
Тема: Роль хімії у створенні нових матеріалів, розвитку нових напрямів технологій
Опрацювати параграф 37 на с. 191, письмово запитання 1-3 на с. 196
29.04.2021
Тема: Неорганічні речовини, їх біологічне значення та застосування
Виконати письмово в зошит завдання 31-42 на с. 188-189
28.04.2021
Тема: Виконання тренувальних вправ та розвязок розрахункових задач
Виконати письмово в зошит завдання 21-30 на с. 187-188
22.04.2021
Тема: Виконання тренувальних вправ та розвязок розрахункових задач
Виконати письмово в зошит завдання 11-20 на с. 186-187
21.04.2021
Тема: Виконання тренувальних вправ та розвязок розрахункових задач
Виконати письмово в зошит завдання 1-10 с .185-186
15.04.2021
Тема: Виконання тренувальних вправ та розвязок розрахункових задач
Виконати письмово в зошит
- 1. Класифікуйте органічні речовини на класи за їхніми молекулярними формулами: С4Н8, CH3NH2, С3Н7СНО, С2Н5СООН, С5Н11ОН, С4Н9СНО, С2Н2, С3Н7ОН, С6Н14, С3Н5(ОН)3, C2H5NH2, (CH3)2NH, СН3СООН, C3H7NH2, С4Н9СООН, С6Н13СНО. Назвіть ці речовини.
- 2. Назвіть речовини за їхніми структурними формулами:

- 3. Складіть структурні формули органічних речовин за їхніми назвами: а) 2,2- диметилпропан; б) 3-етилпент-2-ен; в) 1,1,2-трибромопропан; г) гексахлоробензен; ґ) 3-метилбут-1-ин; д) пентан-2-ол; е) пропан-1,2,3-триол; є) етаналь; ж) 2-метилбутан-2-амін; з) пентанова кислота; и) етилпропаноат.
- 4. Складіть рівняння реакцій за схемою: СН4 → С2Н2 → С2Н4 → С2Н5ОН → СН3СНО → СН3СООН → СН3СООС2Н5. Назвіть продукти реакцій.
- 5. Напишіть рівняння реакцій: а) окиснення глюкози; б) відновлення глюкози; в) взаємодії метанаміну з хлоридною кислотою; г) взаємодії феніламіну з бромом; ґ) горіння метанаміну. Назвіть продукти реакцій.
- 6. Складіть рівняння реакцій за схемою: етен → етин → бензен → циклогексан → бензен → 1,2,3,4,5,6-гексахлороциклогексан.
14.04.2021
Тема: Генетичні звязки між основними класами неорганічних і органічних сполук
Повторити параграфи 34-35, письмово завдання 20-25 на с. 187-188
01.04.2021
Тема: Практична робота 2 Генетичні звязки між неорганічними речовинами
Опрацювати параграф 35, записати всі можливі реакції для практичної роботи перший варіант на с. 181 або всі реікції з відео
31.03.2021
Тема: Генетичні звязки між основними класами неорганічних сполук
Опрацювати параграф 34 на с. 179, письмово завдання 1 а.б. на с 180, переглянути відео та скласти 3-6 тестових запитань
25.03.2021
Тема: Біологічне значення металічних елементів
Опрацювати параграф 32, с. 1-5 на червоні запитання с. 176
24.03.2021
Тема: Біологічне значення неметалічних елементів
Навчальні проєкти 10. Неорганічні речовини у фармації (або у домашній аптечці) і харчовій промисловості. 13 Властивості і застосування карбонатів і ортофосфатів лужних і лужноземельних металічних елементів, солей амонію
Опрацювати параграф 32, с 174-176, письмові відповіді насині запитання 1-3 на с.176
21.01.2021
Тема: Солі, їх поширення в природі. Середні та кислі солі
Опрацювати параграф 27, письмово запитання 1,2,5 на с. 148, завдання 1-2 на с. 148
20.01.2021
Тема: Основи. Властивості гідроксидів Натрію і Кальцію, їх застосування
Опрацювати параграф 26, письмово запитання 1,2 на с. 140, завдання 1-3 на с. 140-141
14.01.2021
Тема: Застосування металів та їхніх сплавів
Опрацювати параграф 25, письмово завдання 1,2 на с. 137
13.01.2021
Тема: Залізо: фізичні і хімічні властивості
Опрацювати параграф 24, скласти характеристику елемента залізо, письмово 1,2 на с. 132
Фото звіти про результати роботи надіслати за адресою olga.panchenko1111@gmail.com або на вайбер +380969968375
28.05.2020
Тема: Повторення
Взаємозв'язок органічних речовин. Вам добре відомо, що хімія досліджує не тільки склад, будову та властивості, а й перетворення речовин. Вивчаючи неорганічну хімію, ви спостерігали це на прикладі генетичних зв'язків між класами неорганічних сполук. В органічній хімії такі зв'язки існують між класами речовин. Маючи прості за будовою речовини, можна за допомогою перетворень добути складніші. Наприклад, з насичених вуглеводнів можна добути ненасичені або галогенопохідні насичених; із ненасичених — бензен, спирти, далі альдегіди, карбонові кислоти, естери.




27.05.2020
Тема: Повторення
І рівень
1. Кількість речовини вимірюється у :
а) 1 л; б) 1 г; в) 1 моль.
2. Обов’язковий елемент у складі оксидів:
а) Гідроген; б) Оксиген; в) Сульфур.
3. Кількість атомів Гідрогену у формулах кислот показує:
а) кількість кислотних залишків;
б) валентність кислотних залишків.
(кожне завдання – 1 бал)
ІІ рівень
Допишіть визначення: оксиди – це складні …., які ….
Як класифікують солі? Наведіть приклад.
В якому ряду сполук є формули лише основ:
а) LiOH, Ca(OH)2, Zn(OH)2, Fe(OH)3.
б) NaOH, CaO, Al(OH)3, SO3.
(кожне завдання – 1 бал)
ІІІ рівень
Напишіть формули кислот за назвами:
а) сульфатна, б) нітратна;
в) хлоридна; г) сульфідна.
( 1 – бал )
Допишіть рівняння реакцій. Поставте коефіцієнти:
а) K2O + H2O = ;
б)Ba(OH)2 + HCl = ;
в) Na + H2O = .
( 2 – бали )
IV рівень
Обчисліть об'єм, що займе 0,5 моль хлороводню.
( 1 – бал )
Напишіть рівняння реакцій, що лежать в основі схеми:
кальцій оксид → кальцій гідроксид → кальцій сульфат → кальцій гідроксид → кальцій хлорид.
( 2 – бали )
20.05.2020
Тема: Повторення
1. Складіть рівняння реакцій, що відбуваються за схемами:
а) S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4;
б) N2 → NO → NO2 → HNO3 → Ca(NO3)2.
2. Складіть рівняння реакцій між: а) азотом і киснем; б) фосфором і киснем; в) вуглецем і сіркою; г) воднем і сіркою. Складіть електронний баланс, укажіть окисник і відновник.
21.05.2020
Тема: Повторення
ОБЧИСЛЕННЯ МАСИ РЕЧОВИНИ ЗА ВІДОМОЮ КІЛЬКІСТЮ І КІЛЬКОСТІ РЕЧОВИНИ ЗА ВІДОМОЮ МАСОЮ.
Обчислення здійснюють виходячи з формули υ =
де М – молярна маса речовини (г\ моль); m – маса речовини (г, кг); υ – кількість речовини (моль)
Задачі для розв’язку письмово:
1. Обчисліть масу ферум (ІІІ) оксиду , узятого кількістю речовини 5 моль.
2. Обчислять масу 0,5 моль води.
3. Обчисліть масу 1.5 моль сульфідної кислоти H2S;
4. Обчисліть масу 10 моль фосфор (У) оксиду
5. Яку кількість речовини становить 4.9 г ортофосфатної кислоти H3PO4;
6. Яку кількість речовини становить 60г натрій гідроксиду NaOH;
7. Обчисліть число молекул, що міститься в 3,2г метану СН4;
8. Яка маса 12,04 * 10'23 молекул азоту N2;
9. Обчисліть число молекул, що міститься в 7,1г хлору Cl2;
10. Яке число атомів і молекул міститься в 10г воднюH2
13.05.2020
Тема: Повторення
1. Які з наведених оксидів взаємодіють з водою? Складіть відповідні рівняння реакцій.
Na2O, СO2, SO3, Cr2O3, SiO2.
2. У результаті згоряння сірковуглецю CS2 витратився кисень масою 24 г і утворилися карбон(ІV) оксид масою 11 г та сульфур(ІV) оксид масою 32 г. Складіть рівняння цієї реакції та обчисліть масу сірковуглецю, що згорів.
3. Доповніть схеми реакцій та назвіть продукти реакцій:
а) К2O + Н2O —> ...; б) SO2 + Н2O —> ...; в) ... + Н2O —> Ва(ОН)2.
14. 05. 2020
Тема: Повторення
Завдання на оксид.
1. Які з наведених оксидів взаємодіють з водою? Складіть відповідні рівняння реакцій.
Na2O, СO2, SO3, Cr2O3, SiO2.
2. У результаті згоряння сірковуглецю CS2 витратився кисень масою 24 г і утворилися карбон(ІV) оксид масою 11 г та сульфур(ІV) оксид масою 32 г. Складіть рівняння цієї реакції та обчисліть масу сірковуглецю, що згорів.
3. Доповніть схеми реакцій та назвіть продукти реакцій:
а) К2O + Н2O —> ...; б) SO2 + Н2O —> ...; в) ... + Н2O —> Ва(ОН)2.
07.05.2020







Письмово в зошит навести приклади застосування хімічних сполук у різних галузях та повсякденному житті.
06.05.2020
Тема: " Зелена" хімія: сучасні завдання перед хімічною наукою та хімічною технологією.
Опрацювати параграф 39, виписати та вивчити визначення, дати письмову відповідь на запитання 4 на с. 205
30.04.2020
Тема: Роль хімії у розв'язанні енергетичної та екологічної проблеми. Навчальний проект: Вирішення проблеми утилізації різних видів електричних ламп.
Хімія та екологія
Опрацювати параграф 39, скласти конспект, Виконати проект на завдану тему "Вирішення проблеми утилізації різних видів електричних ламп." або запропонуйте власний план заощадження енергетичних ресурсів, які використовує ваша родина.
29.04.2020
Тема: Роль хімії у розв'язанні сировинної та продовольчої проблеми
Опрацювати параграф 38, дати письмові відповіді на запитання 1-2 на с. 200
23.04.2020
Тема: Роль хімії у створенні нових матеріалів, розвитку нових напрямів технологій
Опрацювати параграф 37. Виписати та вивчити визначення, дати письмову відповідь на запитання 3 на с. 196 ( на прикладі двох вчених)
22.04.2020
Тема: Неорганічні речовини і їхні властивості. Узагальнення
Продивіться відео за посиланням https://youtu.be/R1A29FE1GDQ
зробити конспект. Повторити параграф 28-30. Виконати письмово завдання 6-8 на с. 185-186.
16.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ ЧИСЛА АТОМІВ У ПЕВНІЙ КІЛЬКОСТІ РЕЧОВИНИ
Обчислення здійснюється за формулою: υ =
де NA– число Авогадро - 6,02 *1023; N – число атомів чи молекул; υ – кількість речовини (моль). Пам’ятайте, 1 моль містить NA частинок.
Задачі для розв’язку:
Обчисліть скільки молекул води міститься в 5 моль цієї речовини.
Скільки молекул аміаку NH3 міститься в 10 моль цієї речовини.
Скільки молекул метану СН4 міститься в 3,3 моль цієї речовини.
Яку кількість речовини становить 1,8 *1023 молекул сірководню Н2S.
Яку кількість речовини становить 4,8 * 1023 молекул нітратної кислоти HNO3.
Яку кількість речовини становить 12,04 *1023 молекул азоту.
Яке число молекул міститься у воді кількістю речовини 0.25 моль.
Яке число молекул та атомів міститься в кисні кількістю речовини 2 моль.
Скільки молекул міститься у метані СН4 кількістю речовини 0,5 моль.
Чи однакове число молекул міститься у чадному газі СО чи вуглекислому газі СО2 кількістю речовини 3 моль.
Повторити параграф 24-27
15.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ МАСОВОЇ ЧАСТКИ ЕЛЕМЕНТА У ФОРМУЛІ
Обчислити масову частку елемента в складі речовини за її формулою означає встановити, яка частина складної речовини припадає на частку кожного елемента.
ω (Е) =
де n – число атомів елемента у формулі речовини;
Е – елемент; ω – масова частка елемента;
Масову частку виражають у відсотках, або частках від одиниці.
Алгоритм розв’язку задач:
Запис скороченої умови задачі;
Обчислюємо відносну молекулярну масу сполуки;
Обчислюємо масову частку елемента за формулою.
Якщо сполука складається з двох елементів, то масову частку другого елемента можна визначити різницею цілого і відомою масовою часткою.
Задачі для розв’язку:
Обчисліть масову частку Оксигену у воді.
Обчисліть масову частку Карбону в диоксиді Карбону СО2;
Обчисліть масові частки елементів у нітратній кислотіHNO3
Обчисліть масові частки елементів у кальцій оксидіCaO
Обчисліть масові частки елементів у метані СН4;
У якій речовині масова частка Карбону більша - у вуглекислому газі СО2 чи чадному газі СО.
Масова частка якого елемента у сполуці AgNO3 найменша
Масова частка якого елемента у сполуціFeSO4 найбільша.
Якого елемента –Феруму чи Купруму – більше в мідному колчедані CuFeS2;
Розрахувати масову частку кристалізаційної води в пентагідратікупрум (ІІ) сульфату CuSO4 * 5H2O
Повторити параграф 20-23
09.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ ВІДНОСНИХ МОЛЕКУЛЯРНИХ МАС РЕЧОВИН
Відносна молекулярна маса чисельно дорівнює сумі відносних атомних мас усіх атомів, що входять до складу молекули речовини.
Задачі для розв’язку:
Обчисліть відносну молекулярну масу кальцій карбонату.
Обчисліть відносну молекулярну масу аміаку.
Молекула сульфатної кислоти складається з двох атомів Гідрогену, одного атома Сульфуру та чотирьох атомів Оксигену. Складіть хімічну формулу кислоти і обчисліть її відносну молекулярну масу.
Молекула карбонатної кислоти складається з двох атомів Гідрогену, атома Карбону та трьох атомів Оксигену. Складіть хімічну формулу даної кислоти та обчисліть її відносну молекулярну масу.
Обчисліть відносну молекулярну масу сполук:
Метану СН4;
Сірчистого газу SO2;
Ферум (ІІІ) гідроксиду
Натрій сульфату
Магній нітрату.
Повторити 15-18 параграфи.
08.04.2020
Тема: Генетичні зв'язки між неорганічними речовинами
Подивиться відео https://youtu.be/t0q0n92QP7o
Опрацювати параграф 34. Виконати завдання 1 с. 180.
28.05.2020
Тема: Повторення
Взаємозв'язок органічних речовин. Вам добре відомо, що хімія досліджує не тільки склад, будову та властивості, а й перетворення речовин. Вивчаючи неорганічну хімію, ви спостерігали це на прикладі генетичних зв'язків між класами неорганічних сполук. В органічній хімії такі зв'язки існують між класами речовин. Маючи прості за будовою речовини, можна за допомогою перетворень добути складніші. Наприклад, з насичених вуглеводнів можна добути ненасичені або галогенопохідні насичених; із ненасичених — бензен, спирти, далі альдегіди, карбонові кислоти, естери.
Запишемо ланцюжок можливих перетворень формулами:

Складіть рівняння реакцій, наведених у схемі, та поясніть, за допомогою яких реакцій відбуваються ці перетворення.
Перетворення речовин є основою органічного синтезу. Завдяки їм створюють нові речовини із заздалегідь визначеними властивостями. Як промислову сировину для органічного синтезу використовують нафту й природний газ.
Причини багатоманітності органічних речовин. Вивчаючи хімію, ви переконалися, що органічних речовин, незважаючи на обмежену кількість хімічних елементів, які утворюють ці сполуки, є значно більше, ніж неорганічних. Тож з'ясуємо, що є причиною такої багатоманітності (рис. 78).

Рис. 78. Основні ознаки багатоманітності органічних речовин
Розглянемо детальніше кожну з цих ознак.
Наявність у молекулах речовин різних зв'язків між атомами Карбону зумовлена тим, що Карбон може витрачати різну кількість електронів на утворення спільних електронних пар з іншими атомами Карбону. Якщо витрачається по одному електрону, утворюється простий (одинарний) зв'язок.
Одинарні зв'язки наявні в молекулах гомологічного ряду метану. Однак є органічні речовини, у молекулах яких атом Карбону витрачає по два або по три електрони на зв'язки з іншими такими атомами. Цим і пояснюється наявність різних гомологічних рядів речовин.
Пригадайте будову молекул етену та етину, поясніть утворення хімічних зв'язків.
Аналогічно до метанових вуглеводнів етен СН2=СН2 та етин СН≡СН можуть утворювати гомологічні ряди. Їхнє утворення супроводжується зростанням карбонового ланцюга на гомологічну різницю, а отже, й ускладненням будови цих речовин.
Наявність у молекулах різних характеристичних груп спричиняє утворення різних класів органічних речовин. Наприклад, речовини, молекули яких містять гідроксильні групи, належать до класу спиртів, що можуть бути одноатомними й багатоатомними.
Пригадайте, які характеристичні (функціональні) групи містять альдегіди, кислоти, естери, аміни. Назвіть кожну з цих груп.
Крім речовин, які містять згадані характеристичні групи, є такі, що проявляють подвійну хімічну природу. Це зумовлено наявністю в молекулі однієї речовини різних характеристичних груп. Наприклад, у складі молекули глюкози є одна альдегідна й п'ять гідроксильних груп, тому її називають альдегідоспиртом; амінокислоти містять аміногрупи й карбоксильні групи, тому можуть проявляти властивості основ і кислот.
Явище ізомерії — одна з важливих ознак різноманітності органічних речовин. Наявність ізомерів зумовлена будовою карбонового ланцюга, який має здатність за певних умов розгалужуватися. Через це речовина, що характеризується однаковим складом молекул, може утворювати різні за хімічною будовою сполуки, які мають різні властивості.
Ознайомимося з комбінуванням структур насиченого вуглеводню гексану:

Назвіть ізомери н-гексану, структурні формули яких наведені вище.
Характер карбонового ланцюга визначається його формою. За однакової кількості атомів Карбону в молекулі карбоновий ланцюг може бути лінійний, у формі трикутника, п'ятикутника, шестикутника.
Урізноманітнення органічних речовин відбувається внаслідок реакцій органічного синтезу: полімеризації та поліконденсації. Їх використовують у виробництві пластмас, синтетичних каучуків і волокон, різних марок синтетичних мийних засобів, ліків, засобів захисту та росту рослин, полімерних матеріалів, а також матеріалів, з яких виготовляють органи-імплантанти, тощо.
Отже, можна зробити висновок, що велика різноманітність органічних речовин створює продукти для життя та збереження життя людини.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Зв'язки між органічними речовинами проявляються в перетвореннях одних класів речовин на інші. Такі зв'язки називають генетичними.
• Перетворення органічних речовин відбуваються під час хімічних реакцій, що характеризують їхні властивості, і реакцій, що є основою органічного синтезу.
• Причини багатоманітності органічних речовин: а) наявність у молекулах простих (одинарних), подвійних і потрійних зв'язків між атомами Карбону; б) наявність різних гомологічних рядів речовин; в) наявність у молекулах різних характеристичних (функціональних) груп; г) явище ізомерії; ґ) характер карбонового ланцюга.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ (виконати письмово два чи більше завдань за вибром)
- 1. Класифікуйте органічні речовини на класи за їхніми молекулярними формулами: С4Н8, CH3NH2, С3Н7СНО, С2Н5СООН, С5Н11ОН, С4Н9СНО, С2Н2, С3Н7ОН, С6Н14, С3Н5(ОН)3, C2H5NH2, (CH3)2NH, СН3СООН, C3H7NH2, С4Н9СООН, С6Н13СНО. Назвіть ці речовини.
- 2. Назвіть речовини за їхніми структурними формулами:

- 3. Складіть структурні формули органічних речовин за їхніми назвами: а) 2,2- диметилпропан; б) 3-етилпент-2-ен; в) 1,1,2-трибромопропан; г) гексахлоробензен; ґ) 3-метилбут-1-ин; д) пентан-2-ол; е) пропан-1,2,3-триол; є) етаналь; ж) 2-метилбутан-2-амін; з) пентанова кислота; и) етилпропаноат.
- 4. Складіть рівняння реакцій за схемою: СН4 → С2Н2 → С2Н4 → С2Н5ОН → СН3СНО → СН3СООН → СН3СООС2Н5. Назвіть продукти реакцій.
- 5. Напишіть рівняння реакцій: а) окиснення глюкози; б) відновлення глюкози; в) взаємодії метанаміну з хлоридною кислотою; г) взаємодії феніламіну з бромом; ґ) горіння метанаміну. Назвіть продукти реакцій.
- 6. Складіть рівняння реакцій за схемою: етен → етин → бензен → циклогексан → бензен → 1,2,3,4,5,6-гексахлороциклогексан.
27.05.2020
Тема: Повторення
ПОВТОРИТИ вивчений матеріал
1. Кількість речовини вимірюється у :
а) 1 л; б) 1 г; в) 1 моль.
2. Обов’язковий елемент у складі оксидів:
а) Гідроген; б) Оксиген; в) Сульфур.
3. Кількість атомів Гідрогену у формулах кислот показує:
а) кількість кислотних залишків;
б) валентність кислотних залишків.
(кожне завдання – 1 бал)
ІІ рівень
Допишіть визначення: оксиди – це складні …., які ….
Як класифікують солі? Наведіть приклад.
В якому ряду сполук є формули лише основ:
а) LiOH, Ca(OH)2, Zn(OH)2, Fe(OH)3.
б) NaOH, CaO, Al(OH)3, SO3.
(кожне завдання – 1 бал)
ІІІ рівень
Напишіть формули кислот за назвами:
а) сульфатна, б) нітратна;
в) хлоридна; г) сульфідна.
( 1 – бал )
Допишіть рівняння реакцій. Поставте коефіцієнти:
а) K2O + H2O = ;
б)Ba(OH)2 + HCl = ;
в) Na + H2O = .
( 2 – бали )
IV рівень
Обчисліть об'єм, що займе 0,5 моль хлороводню.
( 1 – бал )
Напишіть рівняння реакцій, що лежать в основі схеми:
кальцій оксид → кальцій гідроксид → кальцій сульфат → кальцій гідроксид → кальцій хлорид.
( 2 – бали )
20.05.2020
Тема: Повторення
1. Складіть рівняння реакцій, що відбуваються за схемами:
а) S → SO2 → SO3 → H2SO4 → Na2SO4 → BaSO4;
б) N2 → NO → NO2 → HNO3 → Ca(NO3)2.
2. Складіть рівняння реакцій між: а) азотом і киснем; б) фосфором і киснем; в) вуглецем і сіркою; г) воднем і сіркою. Складіть електронний баланс, укажіть окисник і відновник.
21.05.2020
Тема: Повторення
ОБЧИСЛЕННЯ МАСИ РЕЧОВИНИ ЗА ВІДОМОЮ КІЛЬКІСТЮ І КІЛЬКОСТІ РЕЧОВИНИ ЗА ВІДОМОЮ МАСОЮ.
Обчислення здійснюють виходячи з формули υ =
де М – молярна маса речовини (г\ моль); m – маса речовини (г, кг); υ – кількість речовини (моль)
Задачі для розв’язку письмово:
1. Обчисліть масу ферум (ІІІ) оксиду , узятого кількістю речовини 5 моль.
2. Обчислять масу 0,5 моль води.
3. Обчисліть масу 1.5 моль сульфідної кислоти H2S;
4. Обчисліть масу 10 моль фосфор (У) оксиду
5. Яку кількість речовини становить 4.9 г ортофосфатної кислоти H3PO4;
6. Яку кількість речовини становить 60г натрій гідроксиду NaOH;
7. Обчисліть число молекул, що міститься в 3,2г метану СН4;
8. Яка маса 12,04 * 10'23 молекул азоту N2;
9. Обчисліть число молекул, що міститься в 7,1г хлору Cl2;
10. Яке число атомів і молекул міститься в 10г воднюH2
13.05.2020
Тема: Повторення
1. Які з наведених оксидів взаємодіють з водою? Складіть відповідні рівняння реакцій.
Na2O, СO2, SO3, Cr2O3, SiO2.
2. У результаті згоряння сірковуглецю CS2 витратився кисень масою 24 г і утворилися карбон(ІV) оксид масою 11 г та сульфур(ІV) оксид масою 32 г. Складіть рівняння цієї реакції та обчисліть масу сірковуглецю, що згорів.
3. Доповніть схеми реакцій та назвіть продукти реакцій:
а) К2O + Н2O —> ...; б) SO2 + Н2O —> ...; в) ... + Н2O —> Ва(ОН)2.
14. 05. 2020
Тема: Повторення
Завдання на оксид.
1. Які з наведених оксидів взаємодіють з водою? Складіть відповідні рівняння реакцій.
Na2O, СO2, SO3, Cr2O3, SiO2.
2. У результаті згоряння сірковуглецю CS2 витратився кисень масою 24 г і утворилися карбон(ІV) оксид масою 11 г та сульфур(ІV) оксид масою 32 г. Складіть рівняння цієї реакції та обчисліть масу сірковуглецю, що згорів.
3. Доповніть схеми реакцій та назвіть продукти реакцій:
а) К2O + Н2O —> ...; б) SO2 + Н2O —> ...; в) ... + Н2O —> Ва(ОН)2.
07.05.2020
Тема: «ХІМІЯ ТА ПРОГРЕС ЛЮДСТВА»








Письмово в зошит навести приклади застосування хімічних сполук у різних галузях та повсякденному житті.
06.05.2020
Тема: " Зелена" хімія: сучасні завдання перед хімічною наукою та хімічною технологією.
Опрацювати параграф 39, виписати та вивчити визначення, дати письмову відповідь на запитання 4 на с. 205
30.04.2020
Тема: Роль хімії у розв'язанні енергетичної та екологічної проблеми. Навчальний проект: Вирішення проблеми утилізації різних видів електричних ламп.
Значення хімії у розв’язанні енергетичної проблеми
Забезпеченість енергією є найважливішою умовою соціально-економічного розвитку країни, її промисловості, транспорту, сільського господарства, сфер культури і побуту.
Традиційними джерелами енергії є найчастіше невідновні природні ресурси – вугілля, нафта, природний газ, торф, сланці. Останнім часом вони дуже швидко виснажуються. Не дивно, що це породжує енергетичну проблему.
Хіміки вважають, що в майбутньому (приблизно ще років 25–30) нафта збереже свою позицію лідера. Але її внесок в енергоресурси помітно скоротиться і буде компенсуватися зрослим внеском вугілля, газу, водневої енергетики, ядерного пального, енергії Сонця, енергії земних глибин та інших видів відновної енергії, включаючи біоенергетику.
Поповнення паливних ресурсів у майбутньому пов’язують із раціональною переробкою вугілля. Наприклад, подрібнене вугілля змішується з нафтою, на добуту пасту діють воднем під тиском. При цьому утворюється суміш вуглеводнів – штучний бензин.
Дуже перспективною видається воднева енергетика. Вона ґрунтується на спалюванні водню, під час якого не виникають шкідливі викиди.
Невичерпні можливості містить ядерна енергетика. Її розвиток для виробництва електроенергії та теплоти дає змогу вивільнити значну кількість органічного палива.
Великі надії покладаються й на використання сонячної радіації (геліоенергетика). У Криму вже діють сонячні батареї, фотогальванічні елементи, які перетворюють сонячне світло в електрику. Сонячні батареї вже давно застосовують у навігаційних спорудах і на космічних кораблях. На відміну від ядерної, вартість енергії, яку добувають за допомогою сонячних батарей, постійно знижується.
Для виготовлення сонячних батарей головним напівпровідниковим матеріалом є силіцій та його сполуки. Нині хіміки працюють над розробкою нових матеріалів – перетворювачів енергії. Це можуть бути різні системи солей як накопичувачі енергії.
Екологія – це наука про відносини організмів між собою та з довкіллям.
Головними забрудниками довкілля є теплоелектростанції, кольорова металургія, транспорт. Наприклад, щороку в атмосферу викидається 100 млн. тон сульфур(IV) оксиду SO2. Більше половини цієї кількості припадає на частку теплоелектростанцій, чверть – на частку кольорової металургії і лише кілька відсотків – на частку чорної металургії та основної хімічної промисловості. Те саме можна сказати про викиди оксидів нітрогену та вуглекислого газу, про тверді пилові викиди і канцерогенні мікроелементи.
З метою захисту довкілля в хімічній промисловості використовують різні фільтри, пилогазовловлювачі, які значно зменшують викидання шкідливих речовин в атмосферу.
Синтетичні полімери на відміну від природних не розкладаються ферментами і залишаються в природі. Коли ж їх після використання спалюють, то тим самим лише збільшують забруднення повітря. Перед хіміками стоїть завдання розробки способів утилізації синтетичних матеріалів і створення нових полімерів, які б розкладалися в природі.
Дуже гостро постала проблема раціонального використання води і неприпустимості забруднення водойм. При цьому враховують, що прісна вода становить тільки близько 2,5 % від загальної кількості води на Землі. Кардинальне розв’язання проблеми полягає у створенні замкнених (безстічних) технологічних систем, коли використана вода очищується і знову повертається у виробництво.
29.04.2020
Тема: Роль хімії у розв'язанні сировинної та продовольчої проблеми
Значення хімії у розв’язанні сировинної проблеми
Сировиною називають природні матеріали, що використовуються у виробництві промислових продуктів.
Природа, що нас оточує, здається, є невичерпною скарбницею, з якої промисловість бере сировину. Але невідповідність між запасами і споживанням деяких видів сировини висуває проблему її бережливого й раціонального використання. У зв’язку з цим хіміки ставлять перед собою такі найголовніші завдання:
1) розвідування й застосування дешевої сировини, нових видів альтернативних сировинних матеріалів;
2) комплексне використання сировини;
3) розробка нових ефективних методів рециркуляції сировини;
4) використання відходів як сировини.
Комплексне використання сировини спрямоване на застосування всіх її головних частин для добування корисних продуктів або матеріалів.
Рециркуляція, регенерація сировини – це переведення речовин, що прореагували, у початковий стан для їх повторного використання. Наприклад, уже зараз досить широко використовуються метали у вигляді вторинної сировини, так званого скрапу. Майже половина світового виробництва сталі базується на скрапі.
Невичерпним джерелом сировини є промислові й побутові відходи. Завдання хіміків полягає у знешкодженні відходів. Для цього будують спеціальні очисні споруди. Але головне завдання хіміків полягає у створенні безвідходних виробництв, де відходи використовуються для виготовлення необхідних продуктів.
Опрацювати параграф 38, дати письмові відповіді на запитання 1-2 на с. 200
23.04.2020
Тема: Роль хімії у створенні нових матеріалів, розвитку нових напрямів технологій
Значення хімії у створенні нових матеріалів
Речовини, що використовуються для виготовлення будь-якого фізичного тіла, називаються матеріалами.
Розрізняють матеріали металічні та неметалічні. До металічних матеріалів належать сплави на основі заліза – чавун і сталь, на основі міді – бронза і латунь, на основі алюмінію, магнію, ніобію, танталу, цирконію тощо. З металічних сплавів виготовляють теплообмінники, ємкості, мішалки, трубопроводи, контактні апарати та інше.
Для поліпшення якості металічних матеріалів використовують порошкову металургію. Вона включає процеси виробництва неметалічних порошків і спікання з них виробів. Сучасна порошкова металургія займається створенням матеріалів і виробів з таким складом, структурою, властивостями, яких неможливо досягти відомими методами плавлення. Поряд із цим, порошкова металургія вирішує проблему виготовлення й традиційних матеріалів і виробів, але за вигідніших техніко-економічних показників виробництва.
Серед неметалічних матеріалів важливого значення набули полімери на основі фенолоформальдегідних смол, полівінілхлориду, поліетилену, фторопластів. На відміну від металічних, ці матеріали виявляють високу стійкість до агресивних середовищ, мають низьку густину, високу тривкість до стирання, добрі діелектричні та теплоізоляційні властивості.
Останнім часом вимоги до матеріалів неухильно зростають. З огляду на це зростає також роль хімії у створенні нових матеріалів. Особливе місце серед нових матеріалів посідають композити.
Композити – це композиційні матеріали, що складаються з пластичної основи (матриці) та наповнювача.
Серед композитів виділяють кермети (кераміко-металічні матеріали), норпласти (наповнені органічні полімери) і піни (газонаповнені матеріали).
Опрацювати параграф 37. Виписати та вивчити визначення, дати письмову відповідь на запитання 3 на с. 196 ( на прикладі двох вчених)
22.04.2020
Тема: Неорганічні речовини і їхні властивості. Узагальнення
Продивіться відео за посиланням https://youtu.be/R1A29FE1GDQ
зробити конспект. Повторити параграф 28-30. Виконати письмово завдання 6-8 на с. 185-186.
16.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ ЧИСЛА АТОМІВ У ПЕВНІЙ КІЛЬКОСТІ РЕЧОВИНИ
Обчислення здійснюється за формулою: υ =
де NA– число Авогадро - 6,02 *1023; N – число атомів чи молекул; υ – кількість речовини (моль). Пам’ятайте, 1 моль містить NA частинок.
Задачі для розв’язку:
Обчисліть скільки молекул води міститься в 5 моль цієї речовини.
Скільки молекул аміаку NH3 міститься в 10 моль цієї речовини.
Скільки молекул метану СН4 міститься в 3,3 моль цієї речовини.
Яку кількість речовини становить 1,8 *1023 молекул сірководню Н2S.
Яку кількість речовини становить 4,8 * 1023 молекул нітратної кислоти HNO3.
Яку кількість речовини становить 12,04 *1023 молекул азоту.
Яке число молекул міститься у воді кількістю речовини 0.25 моль.
Яке число молекул та атомів міститься в кисні кількістю речовини 2 моль.
Скільки молекул міститься у метані СН4 кількістю речовини 0,5 моль.
Чи однакове число молекул міститься у чадному газі СО чи вуглекислому газі СО2 кількістю речовини 3 моль.
Повторити параграф 24-27
15.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ МАСОВОЇ ЧАСТКИ ЕЛЕМЕНТА У ФОРМУЛІ
Обчислити масову частку елемента в складі речовини за її формулою означає встановити, яка частина складної речовини припадає на частку кожного елемента.
ω (Е) =
де n – число атомів елемента у формулі речовини;
Е – елемент; ω – масова частка елемента;
Масову частку виражають у відсотках, або частках від одиниці.
Алгоритм розв’язку задач:
Запис скороченої умови задачі;
Обчислюємо відносну молекулярну масу сполуки;
Обчислюємо масову частку елемента за формулою.
Якщо сполука складається з двох елементів, то масову частку другого елемента можна визначити різницею цілого і відомою масовою часткою.
Задачі для розв’язку:
Обчисліть масову частку Оксигену у воді.
Обчисліть масову частку Карбону в диоксиді Карбону СО2;
Обчисліть масові частки елементів у нітратній кислотіHNO3
Обчисліть масові частки елементів у кальцій оксидіCaO
Обчисліть масові частки елементів у метані СН4;
У якій речовині масова частка Карбону більша - у вуглекислому газі СО2 чи чадному газі СО.
Масова частка якого елемента у сполуці AgNO3 найменша
Масова частка якого елемента у сполуціFeSO4 найбільша.
Якого елемента –Феруму чи Купруму – більше в мідному колчедані CuFeS2;
Розрахувати масову частку кристалізаційної води в пентагідратікупрум (ІІ) сульфату CuSO4 * 5H2O
Повторити параграф 20-23
09.04.2020
Тема: Виконання тренувальних вправ та розв'язок розрахункових задач.
ОБЧИСЛЕННЯ ВІДНОСНИХ МОЛЕКУЛЯРНИХ МАС РЕЧОВИН
Відносна молекулярна маса чисельно дорівнює сумі відносних атомних мас усіх атомів, що входять до складу молекули речовини.
Задачі для розв’язку:
Обчисліть відносну молекулярну масу кальцій карбонату.
Обчисліть відносну молекулярну масу аміаку.
Молекула сульфатної кислоти складається з двох атомів Гідрогену, одного атома Сульфуру та чотирьох атомів Оксигену. Складіть хімічну формулу кислоти і обчисліть її відносну молекулярну масу.
Молекула карбонатної кислоти складається з двох атомів Гідрогену, атома Карбону та трьох атомів Оксигену. Складіть хімічну формулу даної кислоти та обчисліть її відносну молекулярну масу.
Обчисліть відносну молекулярну масу сполук:
Метану СН4;
Сірчистого газу SO2;
Ферум (ІІІ) гідроксиду
Натрій сульфату
Магній нітрату.
Повторити 15-18 параграфи.
08.04.2020
Тема: Генетичні зв'язки між неорганічними речовинами
Подивиться відео https://youtu.be/t0q0n92QP7o
Опрацювати параграф 34. Виконати завдання 1 с. 180.
Немає коментарів:
Дописати коментар